若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,11.2 L H2O含有的分子数为0.5 NA |
| B.7.8 g过氧化钠与足量水反应,转移电子数为0.2 NA |
| C.常温常压下,8 g CH4含有的分子数为0.5 NA |
| D.常温下,5.6 g铁与盐酸反应,失去的电子数为0.3 NA |
下列实验操作或装置不符合实验要求的是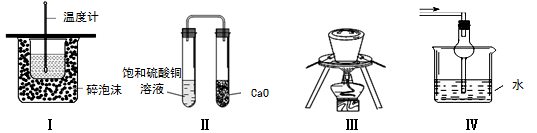
| A.装置Ⅰ可用于测定中和热 |
| B.装置Ⅱ久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C.装置Ⅲ在海带提碘实验中用于灼烧海带 |
| D.装置Ⅳ可用于吸收易溶于水的尾气 |
下列有关物质的性质和应用均正确的是
| A.NH3能氧化氮氧化物,可用于汽车尾气净化 | B.瓷坩埚能耐高温,可用于加热分解石灰石 |
| C.Fe在O2中的燃烧产物可用于制红色涂料 | D.Mg (OH)2受热能分解,可用作阻燃剂 |
右图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
A.该反应的热化学方程式为:2NH3  N2+3H2ΔH =-92 kJ·mol-1 N2+3H2ΔH =-92 kJ·mol-1 |
| B.正反应的活化能大于逆反应的活化能 |
| C.a曲线是未加入催化剂时的能量变化曲线 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1的NaHCO3溶液:K+、Al3+、NO3-、Cl- |
| B.0.1 mol·L-1Fe(NO3)3溶液:K+、NH4+、S2-、SCN- |
| C.能使甲基橙变红的溶液:Ca2+、Na+、ClO-、Cl- |
| D.0.1 mol·L-1的NaAlO2溶液:K+、Na+、SO42-、CO32- |
下列有关化学用语表示正确的是
| A.次氯酸的结构式:H—Cl—O |
| B.质子数为53、中子数为72的碘原子:125 53I |
C.对硝基苯酚的结构简式: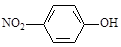 |
D.Na+的结构示意图: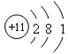 |