已知可逆反应:N2(g)+3H2(g)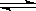 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是
| A.加压可使该反应的反应速率变大 |
| B.该反应中反应物的总能量比生成物的总能量高 |
| C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ |
| D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态 |
在甲乙两个坩埚中分别盛等质量的碳酸氢钠:将甲充分加热,之后冷却至室温;乙不加热。分别向甲、乙两坩埚中加入足量的相同物质的量浓度的盐酸,反应后甲、乙两坩埚中实际消耗的HCl的物质的量之比为 ( )
| A.2:1 | B.1:1 | C.1:2 | D.无法确定 |
已知:①向KMnO4晶体中滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取少量实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是 ( )
| A.上述实验证明氧化性:KMnO4>Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体通入紫色石蕊试液中,溶液只有变红的现象 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
下列各组物质依次表示为a、b、c、d,图中箭头表示一步转化。满足如图所示转化关系的是 ( )
| A.Na Na2O2 NaOH Na2CO3 | B.S SO2 H2SO3 NaHSO3 |
| C.Cu CuO Cu(OH)2 CuSO4 | D.Si SiO2 H2SiO3 Na2SiO3 |
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如下图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是 ( )
A.OH -+HCl ="==" H2O+Cl-
B.Ca(OH)2+Cu2+ ="==" Ca2++Cu(OH)2
C.Fe+Cu2+ ="==" Cu+Fe2+
D.Fe+2H+ ="==" Fe3++H2↑
下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是()
| A.H+、NH4+、Fe2+、NO3- | B.H+、K+、SiO32—、NO3— |
| C.K+、Ba2+、HCO3—、Cl- | D.Mg2+、NH4+、SO42-、K+ |