实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: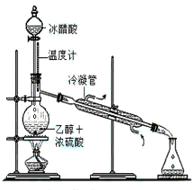
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,
还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的 ,然后慢慢将 加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液先用 溶液处理,再用
(填一种仪器名称)分离。
(5)葡萄糖是生命现象中的一种能量物质。现取少量葡萄糖溶液于试管中,加入新制的Cu(OH)2悬浊液,加热煮沸后现象是 ,说明分子中含有的官能团是 ,反应的化学方程式是:
现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL、0.2mol•L-1的稀H2S04。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2S04时用不到的有_________ (填代号)。
(2)经计算,需浓H2S04的体积为______。现有①10mL②50mL③100mL三种 规格的量筒,你选用的量筒是______ (填代号)。
(3)将浓H2S04加适量蒸馏水稀释后,冷却片刻,随后全部转移到_______mL的容量瓶中,转移时应用玻璃棒_________ 。转移完毕,用少量蒸馏水洗涤____________ 2—3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度________ 处。改用______________ 加蒸馏水到瓶颈刻度的地方,使溶液的________________________________________ 。 振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中错误的是______ (填代号,下同) ,能引起误差偏高的有_________。
①洗涤量取浓H2S04后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2S04溶液冷却至室温就转移到容量瓶中
③将浓H2S04直接倒人烧杯,再向烧杯中注入蒸馏水来稀释浓H2S04
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。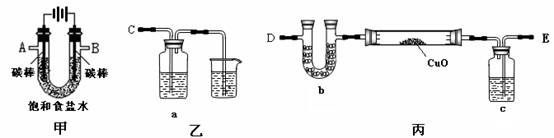
(1)为完成上述实验,正确的连接顺序为_______ 接A, B接_______(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液及对应的现象是 。
(4)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g , 实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
请你分析并回答:你认为不合理的方案及其不足之处是。
②按测得结果更准确的方案进行计算,Cu的相对原子质量。
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
0 |
0 |
实验①和②探究的影响;实验①和③探究的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
某学习小组做以下实验:在溴水中加入足量乙醛溶液,充分反应,溴水褪色。为探究褪色的原因,他们提出了如下三种猜想:
①溴水中的Br2可能与乙醛发生取代反应
②乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应
③乙醛具有还原性,溴水可能将乙醛氧化为乙酸,Br2转化为HBr
为探究哪一种猜想正确,一研究小组提出了如下两种方案:
方案(一):检验褪色后溶液的酸碱性,确定其发生哪类反应
方案(二):测定反应前溴水中Br2的物质的量和反应后 Br-的物质的量确定其发生哪类反应
(1)方案(一)是否可行?______ (填“可行”或“不可行”) ;理由是:
(2)假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=mol, 则说明溴水与乙醛发生了取代反应
若测得反应后n(Br-)=mol,则说明溴水与乙醛发生了加成反应
若测得反应后n(Br-)=mol,则说明溴水将乙醛氧化为乙酸
(3)向含Br2 0.005mol的溴水中加入足量乙醛使其褪色,然后加过量的AgNO3溶液,过滤、洗涤、干燥、称量,得到固体1.88克。已知CH3COOAg易溶于水,通过计算,判断溴水与乙醛发生的反应为(填猜想序号),溴水与乙醛反应的化学方程式为
(4)已知柠檬醛的结构简式为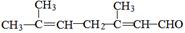 ,若要检验出其中的碳碳双键,其方法是 。
,若要检验出其中的碳碳双键,其方法是 。
水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| 乙酸 |
1-丁醇 |
乙酸丁酯 |
|
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→→→→。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是:;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液D. 饱和 K2CO3溶液
E. 饱和KOH溶液F.过量的 1-丁醇