主链含5个碳原子,有甲基、乙基2个支链的烷烃有
| A.2种 | B.3种 | C.4种 | D.5种 |
茶叶中铁元素的检测可经过以下A、B、C、D四个步骤完成,各步骤中选用的实验仪器不会全部都用上的是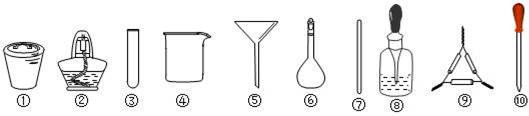
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③和⑧
下列离子方程式中正确的是
| A.铜与浓硝酸反应:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O |
| B.向FeBr2溶液中通入足量Cl2:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- |
| C.AlCl3溶液中加入过量氨水:Al3+ + 3OH- = Al(OH)3↓ |
| D.Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2+ + OH- + HCO3- = CaCO3↓ + H2O |
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.1molFe与1molCl2充分反应,转移的电子数为3NA |
| B.NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g |
| C.含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| D.标准状况下,22.4 LSO3含有NA个分子 |
在下列溶液中,各组离子一定能够大量共存的是
| A.c(H+) = 10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
| D.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
| B.汽油、漂白粉、水玻璃、王水均为混合物 |
| C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |