(共8分)
①金刚石与“足球烯”C60; ②D2O与T2O; ③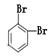 和
和
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖; ⑥16O和18O
(1)__________________________组两种微粒互为同位素;
(2)__________________________组两种物质属于同系物;
(3)__________________________组两物质互为同分异构体;
(4)__________________________组两种物质属于同素异形体。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
请回答下列问题:
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):
SiC_____Si,Si _____ SiO2
(2)工业上高纯硅可通过下列反应制取: SiCl4(g)+2H2 (g) Si(s)+4HCl(g),则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极______________________________________________,
负极:_______________________________________________________________。
③工作时电池正极区的pH________(填“增大”、“减小”或“不变”)。
(2)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是1/2H2+NiO(OH) 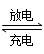 Ni(OH)2。
Ni(OH)2。
电池放电时,负极是____________,负极的电极反应式为_________,正极的电极反应式为___________,正极附近溶液的pH如何变化?______________。
利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。
(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
总反应的离子方程式:______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
| A.利用原电池反应判断金属活动顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已没有实用价值 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________________________________________________________________________________________________________________________(如可靠,此空可不填)。
向2 L密闭容器中通入a mol气体 A和b mol气体B,在一定条件下发生反应;xA(g)+yB(g)  pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少a/2mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=__________;
(2)化学方程式中,x=________、y=________、p=______、q=________;
(3)反应平衡时,D为2a mol,则B的转化率为__________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的ΔH________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率____________(填“增大”、“减小”或“不变”),理由是________________________________________________________;
②平衡时反应物的转化率__________(填“增大”、“减小”或“不变”),理由是
_________________________________________________________________;