有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.元素W和M的某些单质可作为水处理中的消毒剂 |
| C.元素Y的单质只能与氢氧化钠溶液反应而不能与任何酸反应 |
| D.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
下列离子方程式正确的是()
A.用醋酸除去水垢:  |
B.苯酚与碳酸钠反应: |
C.苯酚钠溶液中通入少量CO2: |
D.乙酸乙酯与氢氧化钠溶液反应: |
设NA为阿伏加德罗常数,下列有关说法正确的是()
| A.0.5 mol苯分子中含有C=C双键数为1.5NA |
| B.1 mol甲基(—CH3)所含的电子总数为10NA |
C.标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为 NA NA |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
下列物质中,不能使酸性高锰酸钾溶液褪色且所有原子都处在同一平面的是
| A.已烷 | B.丙炔 | C.苯乙烯 | D.苯 |
下列各有机物的命名中正确的是()
| A.CH3-CH2-CH=CH2 | B. |
C. |
D.CH3OOCC2H5 |
3—丁烯2—甲基丁烷甲基苯酚乙酸乙酯
金属加工后的废切削液中含2%~5%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2 第二步:NH4NO2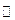 N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是()
①NH4NO2只作氧化剂; ②NH4NO2只作还原剂; ③只有氮元素的化合价发生了变化;④NH4NO2既是氧化剂又是还原剂;⑤N2既是氧化产物又是还原产物。
| A.①③⑤ | B.①④ | C.②③⑤ | D.③④⑤ |