如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是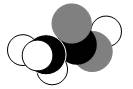
| A.C2H5OH | B.CH3COOH |
| C.CH3CHO | D.C6H5OH |
某同学在实验报告中记录下列数据,其中正确的是( )
| A.用25mL量筒量取12.36mL盐酸 |
| B.用托盘天平称量8.75g食盐 |
| C.用500mL的容量瓶配制450mL溶液 |
| D.用广泛pH试纸测得某溶液的pH为3.5 |
关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
| A.①②③④ | B.②③ |
| C.①②④ | D.②③④ |
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
| A.原子数 | B.分子数 | C.体积 | D.物质的量 |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤.正确的操作顺序是
| A.③②①⑤④ | B.①②③⑤④ |
| C.②③①④⑤ | D.③⑤②①④ |
下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
| A.试管 | B.胶头滴管 |
| C.玻璃棒 | D.漏斗 |