(15分)如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气( )
(2)浓硫酸使木条变黑( )
(3)热的浓硫酸与铜片反应( )
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (选填①10mL、②50mL 、③100mL)规格的量筒;
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是;
(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是。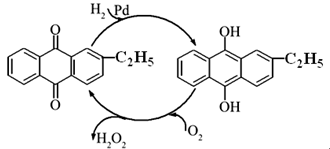
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
| 实验编号 |
T/℃ |
H2O2初始浓度/ mol·L-1 |
FeCl3初始浓度/ mol·L-1 |
| Ⅰ |
20 |
1.0 |
|
| Ⅱ |
50 |
1.0 |
0 |
| Ⅲ |
50 |
0.1 |
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为mol·L-1。
②三组实验中分解速率最快的是(填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 |
第二次 |
第三次 |
第四次 |
|
| 体积(mL) |
17.10 |
18.10 |
18.00 |
17.90 |
计算试样中过氧化氢的浓度为mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果(“偏高”或“偏低”或“不变”)。
(8分)某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。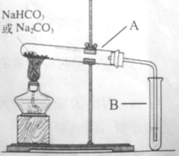
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用右图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是 (填“澄清的石灰水”或“NaOH溶液”)
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有 沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3 NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8、4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为 L(标准状况)
(8分)根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
| 实验操作 |
答案 |
实验现象 |
| (1)让一束光线通过Fe(OH)3胶体 |
A、呈蓝色 B、生成白色胶状沉淀 C、呈现光亮“通路” D、产生红褐色沉淀 |
|
| (2)向盛有FeCl3溶液的试管中加入NaOH溶液 |
||
| (3)向Al2(SO4)3溶液中滴加氨水 |
||
| (4)向土豆片上滴加碘水 |
某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中。
| 编号 |
现象 |
离子方程式 |
| ① |
||
| ② |
||
| ③ |
某学生用0.2000 mol/L KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.将已用蒸馏水洗净的碱式滴定管,再用标准溶液润洗碱式滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米 |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
G.检查酸式滴定管和碱式滴定管是否漏水
H.再重复做滴定实验2~3次,记录并处理数据。
就此实验完成以下填空:
(1)正确操作步骤的顺序是(用字母填写短缺的序号)
→ B →→ C →→ A→→ H
(2)判断到达滴定终点的实验现象是_。
(3)如果不进行B步骤的操作的则对滴定结果的影响是____ ______。(填“偏高”、“偏低”、“不影响”,下同)
(4)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(5)若用酸式滴定管取20.00 mL待测盐酸溶液时,取前有气泡,取后无气泡,其结果会导致测得待测盐酸溶液物质的量浓度。
(6)若称量一定质量的KOH固体(含少量K2CO3)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是