已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g) + 5O2(g) ="=" 4CO2(g) + 2H2O(l);△H = -4b KJ/mol |
| B.C2H2(g) + 5/2O2(g) ="=" 2CO2(g) + H2O(l);△H =" 2b" KJ/mol |
| C.2C2H2(g) + 5O2(g) ="=" 4CO2(g) + 2H2O(l);△H = -2b KJ/mol |
| D.2C2H2(g) + 5O2(g) ="=" 4CO2(g) + 2H2O(l);△H =" b" KJ/mol |
下列实验操作可以达到实验目的的是
| 实验目的 |
实验操作 |
|
| A |
鉴别纯棉织品和人造纤维织品 |
用灼烧方法观察是否有烧焦羽毛气味 |
| B |
检验淀粉水解产物的还原性 |
取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C |
除去乙酸乙酯中混有的少量乙酸 |
加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D |
检验氯仿中的氯元素 |
取少量氯仿加入硝酸银溶液,观察是否出现白色沉淀 |
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
下列说法正确的是
| A.滴定时可用淀粉溶液作指示剂 | B.上述反应为取代反应 |
| C.滴定时应剧烈振荡锥形瓶 | D.脱氢维生素C的分子式为C6H5O6 |
下列化学(或离子)方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO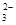 =CO2↑+H2O =CO2↑+H2O |
B.C6H6+HNO3 C6H5NO2+H2O C6H5NO2+H2O |
C.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
| D.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→ CH3COO-+H2O |
有两种气态烃组成的混合气完全燃烧后所得到的CO2和H2O的物质的量随混合烃的总物质的量的变化如下图所示,则下列对混合烃的判断正确的是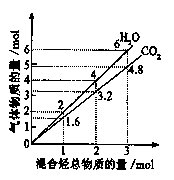
①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷
| A.①②⑤ | B.②④ | C.②⑤ | D.②③ |
现有三组混合液:(1)乙酸乙酯和乙酸钠水溶液;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、分液、蒸馏 |
| C.萃取、蒸馏、分液 | D.分液、蒸馏、萃取 |