某元素的气态氢化物的化学式为XH3,其中X的质量分数约为82.4%,则X在周期表中的位置是
| A.第二周期VA | B.第二周期VⅡA |
| C.第三周期VA | D.第三周期VⅡA |
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属元素,且原子半径Z>W>M。下列叙述正确的是
| A.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素 |
| B.X、M两元素氢化物的稳定性:X<M |
| C.X和W的氧化物均可作耐高温材料,M的氧化物可用于制作太阳能电池 |
| D.X、W组成的化合物水解生成一种可净水的化合物 |
下列判断中一定正确的是
| A.若A2+2D-===2A-+D2,则还原性:D->A- |
| B.若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C.若X2、Y2都是气态单质,且酸性HX>HY,元素原子得电子能力X>Y |
| D.若M、N是同主族元素,且原子序数:M>N,则元素原子得电子能力:M>N |
下列说法正确的是
| A.两种原子形成的共价键一定是极性共价键 |
| B.元素金属性越强,对应单质的还原性越强;元素非金属性越强,对应单质的氧化性越强 |
| C.由金属元素和非金属元素组成的化合物一定是离子化合物 |
| D.按照元素周期表的排布规律,非金属元素最多有23种 |
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2进行喷泉实验,经充分反应后,两瓶内溶液的物质的量浓度大小为
| A.①>② | B.①<② | C.①=② | D.不能确定 |
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是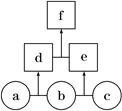
| A.常温下,单质a呈气态 | B.单质c具有强氧化性 |
| C.稳定性:d>e | D.f受热易分解为d和e |