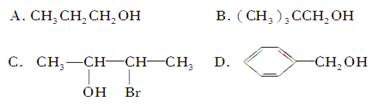下列事实一定能说明HF是弱酸的是


①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①②⑦ | B.②③⑤ | C.③④⑥ | D.①④ |
为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀HNO3酸化;⑤加入NaOH溶液;⑥冷却。正确操作的先后顺序为( )
| A.③①⑤⑥④② | B.③②①⑥④⑤ |
| C.③⑤①⑥④② | D.③⑤①⑥②④ |
下列分子中的所有碳原子不可能处在同一平面上的是

①②③④⑤
| A.②③ | B.①④⑤ | C.①②④ | D.①⑤ |
下列关于芳香烃的叙述中不正确的是
| A.乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响。 |
| B.苯和浓硝酸、浓硫酸混合物在100—1100C才能生成二硝基苯,而甲苯在1000 C时即可生成三硝基甲苯,说明甲基对苯环产生了影响。 |
| C.甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤。 |
| D.除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可。 |
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是
A.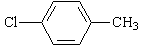 |
B. |
C.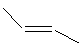 |
D.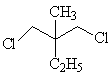 |
下列物质既能发生消去反应,又能氧化成醛的是