设阿伏加德罗常数为NA,下列说法正确的是
| A.1mol CnH2n+2烃分子中,含有碳碳键数目为nNA |
B.一定条件下,密闭容器中加入2mol SO2、1mol O2发生反应2SO2+O2 2SO3,转移的电子数目为4 NA 2SO3,转移的电子数目为4 NA |
| C.53g碳酸钠固体中,碳酸根离子的数目为0.5 NA |
| D.标准状况下,11.2L己烷所含分子数为0.5 NA |
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
H2O/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
α1和α2分别为A、B在两个恒容容器中平衡体系A(g)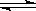 2B(g)和2A(g)
2B(g)和2A(g)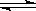 B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是 ( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是 ( )
A.α1、α2均减小 B.α1、α2均增大 C.α1减小,α2增大 D.α1增大,α2减小
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体②H2O ③NaCl固体④CH3COONa固体⑤KCl溶液
| A.①② | B.②③⑤ | C.②④ | D.②④⑤ |
有下列物质:① NaOH固体;②浓硫酸;③ NH4NO3晶体;④ CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是()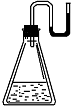
| A.①②③④ | B.①②④ | C.②③④ | D.①②③ |