提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
| |
括号内为杂质 |
除杂试剂 |
操作 |
| 1 |
乙烷(乙烯) |
|
|
| 2 |
乙酸乙酯(乙酸) |
|
|
| 3 |
苯(苯酚) |
|
|
| 4 |
乙醇(水) |
|
|
向一金属易拉罐内(内空)放入一匙某白色晶体(CO2的固体——干冰),摇动几下后,立即注入6mol/L过量的氢氧化钠溶液,用胶布密封罐口。过一段时间后,罐壁变瘪;再过一段时间后,瘪了的罐壁又重新鼓了起来。
⑴要产生上述实验现象,做易拉罐的金属是;
⑵罐壁变瘪的原因是,
离子方程式是;
⑶罐壁再度鼓起的原因是 ,
有4种钠的化合物,W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式
W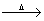 X+CO2+H2O ;Z+CO2
X+CO2+H2O ;Z+CO2 X+O2 ;Z+H2O
X+O2 ;Z+H2O Y+O2↑;X+Ca(OH)2
Y+O2↑;X+Ca(OH)2 Y+CaCO3↓。
Y+CaCO3↓。
W为,X为,Y为,Z为。
金属铁在空气中缓慢氧化生成的产物是(化学式),在O2中燃烧生成的产物是(化学式),铁与水蒸气发生反应的化学方程式是
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被氧化的元素是,氧化剂是和
利用下图所示装置,设计一个简单的一次性完成的实验,验证乙酸、碳酸和苯酚的酸性强弱。
(1)用导管口的字母表示所选用装置的连接顺序:。
(2)装置A中,广口瓶中所放入的物质是,分液漏斗中所放入的物质是。
(3)装置B中所加入的物质是,其作用是。
(4)装置C中反应的离子方程式为。