下列叙述正确的是 ( )
| A.1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C.欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
下列化学用语或模型表示正确的是
A.氯化氢的电子式: |
B.甲烷的球棍模型: |
C. 名称为2—甲基-2-戊烯 名称为2—甲基-2-戊烯 |
D.三硝基甲苯的结构简式: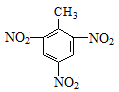 |
化学与生活、生产、社会密切相关。下列说法错误的是
| A.在工业生产中,尽量使用纯液态有机物代替水作溶剂 |
| B.垃圾是放错地方的资源,应分类回收利用 |
| C.为了防止白色污染应提倡减少塑料袋的使用 |
| D.绿色化学的核心是利用化学原理消除污染的产生 |
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
下列离子方程式正确的是
| A.稀硝酸与氢氧化钾溶液反应H++OH-=H2O |
| B.铝与稀盐酸反应Al+2H+=Al3++H2↑ |
| C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| D.二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O |
N2+3H2一定条件2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |