下列反应的离子方程式不正确的是 ( )
A.醋酸加入氨水:CH3COOH+NH3·H2O CH3COO-+NH4++H2O CH3COO-+NH4++H2O |
| B.足量氯气通入碘化亚铁溶液中:3Cl2+2Fe2++4I- |
| C.过量的NaHSO4与Ba(OH)2溶液反应 Ba2++2OH-+2H++SO42-══BaSO4↓+2H2O |
| D.向次氯酸钙溶液中通入二氧化硫:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+4H+ + 2Cl- + SO42- |
下列说法不正确的是
| A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。PM2.5被吸入人体后会直接进入支气管,易引发包括哮喘、支气管炎和心血管病等方面的疾病 |
| B.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料 |
| D.生物柴油的主要成分是利用从泔水中提取的地沟油与甲醇反应生成的脂肪酸甲酯类化合物,与石化柴油有本质不同 |
以焦炭为主要原料合成NH3,为了使通入合成塔的N2与H2保持1∶3的体积比,则焦炭(不计燃烧中的消耗)与空气的物质的量之比约为( )(N2约占空气总体积的4/5)
| A.1∶3 | B.3∶2 | C.6∶5 | D.4∶3 |
化学无处不在,下列与化学有关的说法不正确的是
| A.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
钠型离子交换剂磺化煤(NaR)可使硬水中的钙、镁离子通过离子交换而软化。海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子等)依次通过两种离子交换树脂A、B(如图所示),下列叙述不正确的是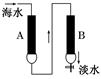
A.A为氢型离子交换树脂(HR),B为羟型离子交换树脂(ROH)
B.A为羟型离子交换树脂(ROH),B为氢型离子交换树脂(HR)
C.HR与镁离子的反应可表示为: 2HR+Mg2+===MgR2+2H+
D.ROH与氯离子的反应可表示为: ROH+Cl-===RCl+OH-
下列有关铁、铝的冶炼的说法中,正确的是
| A.冶金工业中,金属铁的冶炼主要采用电解法 |
| B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气 |
| C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石 |
| D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽 |