有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A.A、B的相对分子质量之差为60 B.1个B分子中应当有2个氧原子
C.A的分子式是C7H6O3 D.B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
pH=1的三种酸溶液A、B、C各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )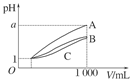
A.溶液的物质的量浓度C>B>A
B.酸性A>B>C
C.若a=4,则A是强酸,B、C是弱酸
D.若1<a<4,则A、B、C都是弱酸
已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是( )
| A.该溶液的温度高于25℃ |
| B.由水电离出来的c(H+)=1×10-10mol·L-1 |
| C.c(H+)=c(OH-)+c(SO42-) |
| D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性 |
一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
| 物质 |
AgCl |
AgI |
Ag2S |
| 颜色 |
白 |
黄 |
黑 |
| Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是( )
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
下列说法正确的是( )
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |