用Pt电极电解含有各0.1mol的Cu2-和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n (mol)的关系见图示。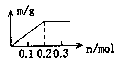
则离子的氧化能力由大到小排列正确的是: ( )
| A.Cu2+>X3+>H+ | B.Cu2+>H+>X3+ |
| C.X3+>H+>Cu2+ | D.H+>X3+>Cu2+ |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1∶7 | B.1∶9 | C.1∶5 | D.2∶9 |
将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
| A.c(HCO3-)略大于c(CO32-) |
| B.c(HCO3-)等于c(CO32-) |
| C.c(Na+)等于c(CO32-)与c(HCO3-)之和 |
| D.c(HCO3-)略小于c(CO32-) |
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是
| A.A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B.整个过程中阳极先产生Cl2,后产生O2 |
| C.BC段阳极产物是Cl2 |
| D.CD段电解的物质是水 |
下列表示对应化学反应的离子方程式正确的是
| A.向醋酸钠水溶液中通入少量CO2 2CH3COO— + CO2+H2O=2CH3COOH + CO32— |
| B.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+=2Fe(OH)3 + 3Mg2+ |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
下列说法正确的是
| A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
B.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |