下列离子方程式正确的是( )
| A.向漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B.将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO完全沉淀: NH+Al3++2SO+2Ba2++4OH-= Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示。下列有关说法错误的是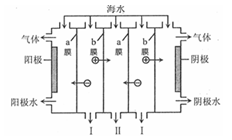
A.阳极可发生电极反应: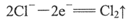 |
| B.a膜为阴离子交换膜, b膜为阳离子交换膜 |
| C.阴极附近溶液的pH减小 |
| D.I、II分别是淡水、浓海水出口 |
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质.
| A.②④ | B.①②④ | C.①③⑤ | D.②③④ |
己知:
下列推断正确的是
A.若CO的燃烧热为 ,则H2的燃烧热为 ,则H2的燃烧热为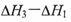 |
B.反应 |
C.若反应②的反应物总能量低于生成物总能量,则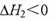 |
D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则 |
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z一定都是非金属单质 |
| B.X、Y、Z一定都是金属单质 |
| C.X、Y、Z中至少有一种是非金属单质 |
| D.X、Y、Z中至少有一种是金属单质 |
紫苏醇的结构简式如右图所示。下列有关紫苏醇的说法正确的是
A.与乙醇互为同系物 |
| B.一定条件下能与乙酸发生酯化反应 |
| C.存在属于芳香族化合物的同分异构体 |
| D.能与溴水、酸性高锰酸钾溶液发生加成反应 |