物质的量均为1mol的下述物质长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是( )
①氧化钠 ②过氧化钠 ③氢氧化钠 ④亚硫酸钠
| A.①>②>④>③ | B.①=③>②>④ |
| C.③>①=②>④ | D.④>③>②>① |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是 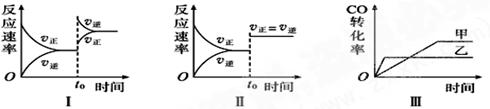
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
下列反应处于平衡状态,2SO2(g)+O2(g) 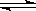 2SO3(g) △H=-196.6kJ·mol-1,以下措施使平衡向右移动的是:①降低温度;②增大压力; ③加入氧气;④去掉部分三氧化硫;⑤恒压时通入少量N2
2SO3(g) △H=-196.6kJ·mol-1,以下措施使平衡向右移动的是:①降低温度;②增大压力; ③加入氧气;④去掉部分三氧化硫;⑤恒压时通入少量N2
| A.①②③④ | B.②③④⑤ | C.②④⑤ | D.全部 |
已知HClO酸性是比H2CO3弱,反应Cl2+H2O  HCl+HClO达平衡后,要使HClO浓度增加可加入
HCl+HClO达平衡后,要使HClO浓度增加可加入
| A.H2O | B.HCl | C.CaCO3 | D.NaOH(s) |
一定量混合气体在密闭容器中发生反应:xA(g)+yB(g) zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
| A.平衡向右移动 | B.x+y>z |
| C.B的转化率提高 | D.C的体积分数增加 |
下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水法收集Cl2 |
| B.温度控制在500℃有利于合成氨反应 |
| C.打开碳酸饮料会有大量气泡冒出 |
D.工业制钾 Na(l)+KCl(l)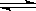 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 |