I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2 (1)
平均反应速率的计算式为v(S2O82-)=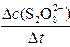 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 =" " S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实 验 编 号 |
① |
② |
③ |
④ |
⑤ |
|
| 试剂 用量 (mL) |
0.20 mol·L-1(NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
| 0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
| 0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
| 0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
| 0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
| 0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
| 20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。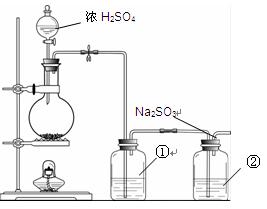
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,D仪器的名称,此实验D仪器中需要
放入溶液,A中应预先加入的试剂是,A中反应的离子方程式
为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”), 在C中收到的气体主要为;当C瓶或A瓶中的气泡时,将活塞E(填“打开”
或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是:
_;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
。
“套管实验”具有装置简洁便利等有优点,结合图示回答有关问题
(1)欲利用图1比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物。最好应在大试管底部加入(填化学式),石灰水变浑浊的烧杯是(填:甲、乙) 。
请写出试管中反应的化学反应方程式:
(2)使用图2中大小不一的试管,用铝粉和氢氧化钠溶液制取氢气,并收集一试管氢气,
将铝粉和氢氧化钠溶液放入试管内(填:大、小)组成发生装置,请写出该反应的离子
方程式为:为了使得所收集的氢气能较
纯净地充满所收集氢气的试管,应如何操作,写出大致的步骤:
。
(Ⅰ)已知常温下苯酚在水中溶解度不大,为8.2g/100g水,其饱和溶液的物质的量浓度约为0.8mol/L。为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计了如下实验方案:
甲:向两只试管中,分别注入0.8mol/L的乙醇和苯酚水溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙:在两只试管中,分别放入1 g乙醇和苯酚晶体,各注入3mL蒸馏水,振荡,得到乙醇溶液和苯酚浊液,再向两试管中逐滴加入5molL的NaOH溶液,观察其中的变化。
(1)苯酚溶液与钠反应的离子方程式为_______________________________________。
(2)对于甲、乙两个实验方案,他们能否达到实验目的?理由各是什么?
__________________________________________________________________________。
(Ⅱ)在分析甲、乙两同学实验方案的基础上,丙同学进行了下列对比实验:
在两只试管中,分别放入2 g无水乙醇和苯酚晶体,用约60℃的水浴加热,待苯酚熔成液态后,再向两试管中各放入一小块金属钠。在乙醇中,钠块能与乙醇反应产生气体,约3min后钠块消失,溶液保持澄清;在苯酚中,钠块表面有少量气泡,约2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
(3)丙同学的实验表明,苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其主要原因是_________________________________,因此苯酚熔融液和无水乙醇与钠反应的有关事实_________(填“能”或“不能”)作为判断分子里羟基上氢原子哪个更活泼的依据。
(4)请你设计一个探究苯酚和乙醇分子中羟基上氢原子活泼性的实验方案:
____________________________________________________________________________。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: 

(1)在虚线框内画出实验操作①的仪器装置示意图(见题后说明)。实验操作③的名称是___________,所用主要仪器名称为___________。
(2)提取碘的过程中,可供选择的有机试剂是___________ (填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量Icl,为消除此杂质,使碘全部游离出来,应加入 适量___________ (填序号)溶液,反应的离子方程式为______________________。
适量___________ (填序号)溶液,反应的离子方程式为______________________。
A.KIO3B.HClO C.KID.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如上图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。
①___________,②___________,③___________,
④___________,⑤___________,⑥___________。
(5)实验中使用水浴的原因是______________________,最后晶体碘聚集在___________ (填仪器名称)中。
说明:实验装置中仪器用下面方法表示。铁架台、连接胶管等不必画出,如需加热,在仪器下方用“△”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。
11分).某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)操作II必须用到的仪器是 。(填下列编号)
| A.50mL烧杯 | B.20mL量筒 | C.50mL量筒 | D.25mL滴定管 |
(2)请写出加入溴水发生的离子反应方程式 ,
(3)检验沉淀是否已经洗涤干净的操作是
。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)