根据表1信息,判断以下叙述正确的是 ( )
表1:部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、—2 |
—2 |
| A.氢化物的稳定性为H2T<H2R | B.单质与稀盐酸反应的速率为L<Q |
| C.M与T形成的化合物具有两性 | D.L2+与R2-的核外电子数相等 |
关于下列各装置图的叙述中,正确的是

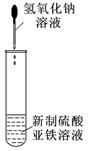
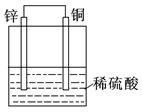
①②③④
| A.实验室用装置①制取氨气 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④是原电池,锌电极为负极,发生还原反应 |
闵恩泽因在中国炼油催化剂方面的突出贡献而荣获2007年国家最高科学技术奖。有一类常用的石油裂化催化剂,因在其结构中存在某些网络状的硅酸盐而具有笼状结构,可以有选择性地吸附一定大小的分子,对不同大小的分子起筛分作用,被称为“分子筛”。某种分子筛的化学式为:Na8[(AlO2)8(SiO2)40]·24H2O,以下有关该分子筛的说法正确的是
| A.该分子筛可以耐一切酸碱的腐蚀 |
| B.该分子筛是一种新型无机非金属材料 |
| C.该分子筛是一种传统无机非金属材料 |
| D.可将其化学式改写为氧化物的形式,说明该分子筛是由不同的氧化物混合而成的 |
下列反应所得溶液中一定只含有一种溶质的是
| A.向稀硝酸中加入铁粉 |
B.向稀盐酸中滴入少量的NaAl O2溶液 O2溶液 |
C.向 NaOH溶液中通入CO2气体 NaOH溶液中通入CO2气体 |
| D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH) 2溶液 |
某试管中盛装的是红棕色气体(可能是两种气体的混合物),当倒扣在盛水的水槽中时,试管内水面上升,但不能充满试管,当试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,则原来试管中盛装的气体是
| A.一定是O2与NO2的混合气体 | B.可能是NO和NO2的混合气体 |
| C.可能是N2与NO2的混合气体 | D.只可能是NO2一种气体 |
古代曾用绿矾强热得到硫酸、红色粉末和刺激性气体,此反应属于
| A.有氧化还原的分解反应 | B.无氧化还原的分解反应 |
| C.只是氧化还原反应 | D.只是分解反应 |