氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是__________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是_________________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是____________________。
②肼可用作火箭燃料,燃烧时发生的反应是: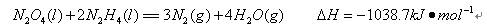
若该反应中有4mol N—H键断裂,则形成的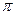 键有___________mol。[
键有___________mol。[
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________________(填标号)。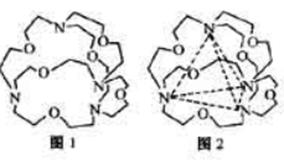
a.CF4 b. CH4 c. NH4+ d.H2O
有关下列①~④四个装置的描述正确的是
| A.装置①工作时溶液中OH—向阳极移动,因此阳极附近溶液先变红色 |
| B.装置②中Zn作正极,Cu作负极 |
| C.根据装置③可实现对铁制品表面镀铜 |
| D.根据装置④可实现对铁闸门保护 |
已知2H2(g)+O2(g) =2H2O(l)△H=—571.6kJ·mol—1,2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ·mol—1。下列说法正确的是
| A.1molH2O(l)变成1mo1H2O(g),吸收88 kJ能量 |
| B.1 molH2O(g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.2 molH2(g)和1molO2(g)的总能量小于2molH2O(l)的能量 |
| D.可以寻找特殊催化剂使H2O分解,同时放出能量 |
下列离子方程式书写正确的是
| A.NaHCO3溶液中加入NaOH 溶液:HCO3—+OH—=CO2↑+H2O |
| B.在NaOH溶液中滴入少量AlC13溶液:Al3++3OH—=Al(OH)3↓ |
| C.甲酸溶液中滴入NaOH溶液:HCOOH+OH—=HCOO—+H2O |
| D.CO2通入CaCl2溶液:CO2+H2O+Ca2+=CaCO3↓+2H+ |
科学解释能力是科学素养的重要组成部分。下列对实验现象或操作的解释不合理的是
| 操作及现象 |
解释 |
|
| A |
在AgI饱和溶液中滴加0.1mol·L—1NaCl溶液,出现白色沉淀 |
AgCl的溶解度或Ksp比AgI小,生成更难溶的AgCl沉淀 |
| B |
盛放浓NaOH溶液的试剂瓶用玻璃塞久后,瓶塞很难打开 |
NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C |
配制FeC13溶液时加入适量盐酸酸化 |
抑制Fe3+水解,防止所配制溶液变浑浊 |
| D |
将氯气通入紫色石蕊溶液中,溶液先变红,后褪色 |
氯气与水反应生成盐酸和次氯酸,溶液显酸性使石蕊溶液变红,次氯酸具有漂白性,使溶液褪色 |
下列离子或分子能大量共存于同一溶液中的是
| A.H2O2、H+、Fe3+、Cl— |
| B.Cl2、OH—、K+、NH4+ |
| C.H+、CH3CH2OH、SO42—、MnO4— |
| D.Ba2+、NO3—、Na+、NH3·H2O |