a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为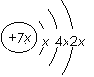 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为  。下列比较中正确的是( )
。下列比较中正确的是( )
| A.原子半径:a>c>d>b | B.非金属性 b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性c>d>a |
下列元素中,最高正化合价数值最大的是()
| A.C | B.S | C.F | D.Ne |
1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是()
| A.Cl- | B.Na+ | C.O2- | D.S2- |
各组元素中,按最高正价递增顺序排列的是()
A.F、O、N、I B.K、Mg、C、S C.C、N、O、F D.Li、Na、K、Rb
下列排列顺序中错误的是()
| A.原子半径:O<S<Na | B.稳定性:PH3>H2S>NH3 |
| C.酸性:H3PO4<H2SO4<HClO4 | D.碱性:Al(OH)3<Mg(OH)2<NaOH |
运用元素周期律分析下列推断,其中错误的是()
| A.已知Ra是第七周期、ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 |
| B.已知As是第四周期、ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强 |
| C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈 |
| D.已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al小 |