孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 ________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式) 。
。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到 。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(1)下列有机物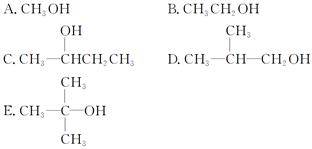
其中能被氧化成醛的有______________,不能被催化氧化的有____________,可发生
消去反应的有____________
(2)有机物A为茉莉香型香料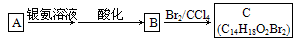
①A分子中含氧官能团的名称是____________.
②C的分子结构可表示为(其中R和R′代表不同的烃基):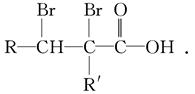
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂.请按要求填空: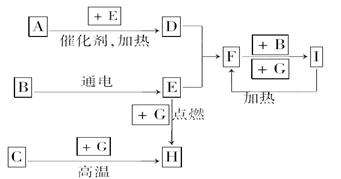
(1)写出下列物质的化学式:
A:________;B:________;C:________.
(2)写出F+B―→I的化学方程式_______________________________.
(3)写出G和I的浓溶液反应的化学方程式______________________________________.
(1)下图为某市售盐酸试剂瓶标签上的部分数据.问: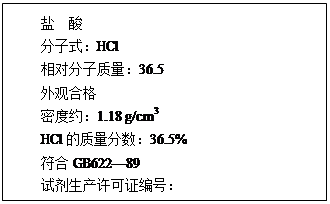
该盐酸的物质的量浓度为多少?(列式计算)
(2) 已知锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。请回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
①硫酸铝和氢氧化钠②硫酸铝和氨水
③硫酸锌和氢氧化钠④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式.。
(1) 已知下列变化过程中,0.2 mol RxO42—参加反应时,共转移0.4 mol电子.
RxO+MnO4—+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2) 在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
(3)要使含a mol Al3+的A溶液中铝元素和含有b mol AlO2—的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)
(1)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3 + 6Zn + 12HCl = 6ZnCl2 + 2AsH3↑+ 3H2O,
反应中氧化剂是,氧化产物是;
被氧化的元素是,还原产物与氧化剂的物质的量比,电子转移总数是。
(2)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
①请写出并配平上述反应的化学方程式:
②若该反应所用的硫酸锰改为氯化锰(MnCl2),当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有。