工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)  Si(s)+4HCl(g)
Si(s)+4HCl(g)  mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
下列有关叙述不正确的是
| A.等浓度的NaCN、NaHSO3混合溶液中:c(HCN)+c(CN-)= c(HSO3-)+c(H2SO3) |
| B.pH= 4.5的食醋中c(H+)是pH= 6.5的番茄汁中c(H+)的100倍 |
| C.10 ml pH=2的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的弱 |
| D.pH= 4.5的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
25℃某浓度的盐酸、氯化铵溶液中水电离出的氢离子浓度分别为:1.0×10-amol·L-1、
1.0×10-bmol·L-1,则这两种溶液的pH之和为
| A.14-a+b | B.14+a+b | C.14-a-b | D.14+a-b |
c(H+)相同的等体积的两份溶液A和B:A为盐酸,B为醋酸。分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是
① 反应所需要的时间B>A② 开始反应时的速率A>B
③ 参加反应的锌的物质的量A=B④ 反应过程的平均速率B>A
⑤ 盐酸里有锌剩余⑥ 醋酸里有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
在某温度下,在一容积可变的容器中,反应2A(g)+B(g) 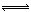 2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B. 均加倍C. 均增加1mol D. 均减少1mol
将2.0 mol SO2气体和2.0 mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 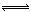 2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是
2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是
| A.1.6 mol SO2+0.3 mol O2+0.4 mol SO3 |
| B.4.0 mol SO2+1.0 mol O2 |
| C.2.0 mol SO2+1.0 mol O2+2.0 mol SO3 |
| D.3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |