将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。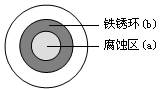
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- Cu2+ Cu2+ |
今有0.1 mol·L-1 Na2SO4溶液300 mL,0.1 mol·L-1 MgSO4溶液200 mL和0.1 mol·L-1 Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是()
mL和0.1 mol·L-1 Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是()
| A.1∶1∶1 | B.3∶2∶2 | C.3∶2∶3 | D.1∶1∶3 |
下列叙述正确的是()
A.同温同压下,任何相同体积的物质 ,它们的物质的量必相等 ,它们的物质的量必相等 |
| B.任何条件下,等物质的量的二氧化碳和一氧化碳所含的分子数必相等 |
| C.1L二氧化碳气体一定比1L氮气的质量大 |
| D.等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
V2O3和V2O5按不同的物质的量之比 混合,可按计量完全反应.今欲制备V8O17,则V2O3和V2O5的物质的量之比应为()
混合,可按计量完全反应.今欲制备V8O17,则V2O3和V2O5的物质的量之比应为()
| A.1∶2 | B.2∶1 | C.3∶5 | D.5∶3 |
下列化学反应的离子方程式正确的是()
| A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O |
| D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
(2010·北京海淀)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,SO42-物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为()
| A.0.1 mol·L-1 | B.0.15 mol·L-1 |
| C.0.2 mol·L-1 | D.0.25 mol·L-1 |