直接NaBH 4/H 2O 2燃料电池(DBFC)的结构如下图:
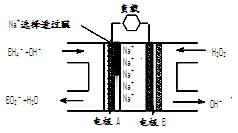
有关该电池的说法正确的是
A.电极B材料中包含MnO 2层,MnO 2可起催化作用
B.电池负极区的电极反应为:BH 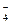 +8OH ――8e -=BO
+8OH ――8e -=BO 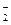 +6H 2O
+6H 2O
C.放电过程中,Na + 从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH 2O 2溶液,理论上流过电路中的电子为6N A个
CO(g)+H2O(g) H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
H2(g)+CO2(g)ΔH﹤0,在其他条件不变的情况下
| A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.不用稀硫酸而用浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片而用铁粉 |
下列措施肯定能使化学平衡移动的是
| A.增大反应物的量 | B.增加压强 |
| C.升高温度 | D.使用催化剂 |
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2mol/L。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2mol/L。下列说法正确的是
| A.4min时,M的转化率为80% |
| B.4min时,用M表示的化学反应速率为0.8mol/(L·min) |
| C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D.4min时,E的物质的量浓度为1.6mol/L |
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
| A.△H1>0,△H3<0 | B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 | D.△H3=△H4+△H5 |