下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+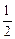 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+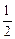 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+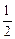 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
设NA代表阿伏加德罗常数的数值,下列说法正确的是()
| A.12.5mL 16mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C.1L 1 mol·L-1的醋酸溶液中离子总数为2NA |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是()
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D.电解MgCl2溶液,可制得金属镁 |
下列依据热化学方程式得出的结论正确的是
| A.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,下列研究目的和示意图相符的是
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的影响(p2>p1) |
温度对反应的影响 |
平衡体系中增加N2的浓度对反应的影响 |
催化剂对反应的影响 |
| 示意图 |
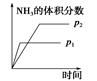 |
 |
 |
 |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,得b克固体 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。 |
| D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |