已知反应:
①25℃、101kP a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是 ( )
| A.N2H4的燃烧热大于534 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量 |
目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克带电量为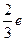 ,d夸克带电量
,d夸克带电量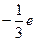 ,e为基元电荷。下列论断可能正确的是()
,e为基元电荷。下列论断可能正确的是()
| A.质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 |
| B.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 |
| C.质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 |
| D.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成 |
氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出氢气。下列叙述正确的是( )
| A.NaH在水中显酸性 | B.NaH中氢离子的电子层排布与氦原子相同 |
| C.NaH中氢离子半径比锂离子半径小 | D.NaH中氢离子可被还原成氢气 |
目前科学家已经通过实验得到了带正电荷的电子,叫做正电子。无独有偶,自然界中还存在反质子。正电子、反质子都属于反粒子,它们跟普通电子和质子的质量和电荷量都相等,但是电性相反。科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。2001年,美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的之一就是为了探索反物质的存在。1998年的年初和年底,欧洲和美国的科研机构先后宣布:它们分别制造出了9个和7个没有中子的反氢原子,这是人类探索反物质的一大进步。试根据你的经验推测:没有中子的反氢原子是( )
| A.由1个带正电的质子和1个带负电的电子构成的 |
| B.由1个带负电的质子和1个带正电的电子构成的 |
| C.由1个不带电的质子和1个带负电的电子构成的 |
| D.由1个带负电的质子和1个带负电的电子构成的 |
X、Y、Z、R分别代表4种元素。a、b、c、d分别是aXm+、bYn+、cZm-、dRn-离子的核电荷数,已知aXm+、bYn+、cZm-、dRn-离子具有相同的电子层结构,则下列关系正确的是()
| A.a-c="2n" | B.a-b="n-m" | C.c-d="m+n" | D.b-d=2n |
A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是()
| A.A和M原子的电子总数之和可能为11 | B.A和M的原子序数之差为8 |
| C.A和M原子的最外层电子数之和为8 | D.A和M原子的最外层电子数之差为7 |