2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下: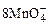 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O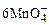 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______ +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M="392" g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛100 mL某浓度的H2SO4溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量W与加入NaOH溶液的体积V的关系如图所示。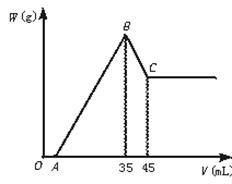
求(1)H2SO4溶液的物质的量浓度是多少?
(2)若A="2.3" mL,铝土矿中Al2O3的质量百分含量是多少?
某空气污染监测仪是根据SO2与Br2的定量反应来测定空气中SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解槽阳极的氧化反应,电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO2的含量时,空气(已除尘)以1.5×10-4m3/min的流速进入电解槽的阳极室,电流计显示电子通过的速率为8.56×10-11mol/s,此条件下能够保持电解槽中Br2浓度恒定并恰好与SO2完全反应(设空气中不含能与溴反应的其它杂质)。
(1)写出此监测过程中发生反应的化学方程式。
(2)计算该地区空气中二氧化硫的含量[单位:g/(m3空气)]。
氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比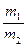 =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?
计算:(1)碱石灰吸收后所剩气体的体积(标准状况下)。
(2)原混合气体中CH4跟O2的体积比。
在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。