xR2++yH++O2=mR3++nH2O的离子方程式,对m和R3+判断正确的是 ( )
| A.m=4,R3+是氧化产物 | B.m=y,R3+是氧化产物 |
| C.m=2,R3+是还原产物 | D.m=y/2,R3+是还原产物 |
在一密闭容器中进行反应:2SO2(g)+O2(g) 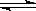 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
| A.O2为0.15mol∙L-1 | B.SO2为0.25mol∙L-1 |
| C.SO3为0.4mol∙L-1 | D.O2、SO3的浓度相等 |
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用如图表示,下列叙述中不正确的是()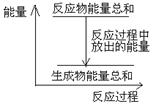
| A.1 molZn的能量高于1 molH2的能量 |
| B.用锌粉代替锌粒,速率会加快 |
| C.如果Zn足量,反应速率会经历由慢到快到慢的过程 |
| D.反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 |
某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含电子的物质的量是:()
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g)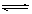 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是()
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是()
A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
关于原电池说法不正确的是:( ) 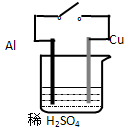
| A.如图所示原电池中,Cu为正极 |
| B.如图所示原电池中,开关闭合时,化学能主要转变为电能;断开时,化学能主要转变为热能 |
| C.在原电池中,负极上发生氧化反应,正极上发生还原反应 |
| D.在原电池中,电子从负极经过电解质溶液流向正极 |