下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+ O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+ O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+ O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是()
| A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
| B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
| C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 |
| D.步骤(2)产物中残留的烯丙醇可用溴水检验 |
下列有关化学反应表达正确的是()
| A.甲醛溶液与足量的银氨溶液共热: HCHO+4[Ag(NH3)2]++4OH-  CO CO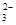 +2NH4++4Ag↓+6NH3+2H2O +2NH4++4Ag↓+6NH3+2H2O |
B.服用阿司匹林过量出现水杨酸(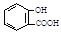 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: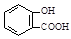 + 2 HCO3- → + 2 HCO3- →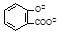 + 2 CO2↑ + 2 H2O + 2 CO2↑ + 2 H2O |
| C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: CH2BrCOOH+OH- 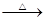 CH2BrCOO-+H2O CH2BrCOO-+H2O |
D.苯酚钠溶液中通入少量CO2: CO2+H2O+2C6H5O- → 2C6H5OH+2CO |
下图表示4-溴-1-环己醇所发生的4个不同反应。产物只含有一种官能团的反应是()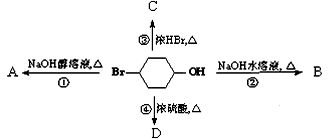
| A.②③ | B.①④ | C.①②④ | D.①②③④ |
下列说法不正确的是()
| A.醋酸和硬脂酸互为同系物,C2H6和C9H20也互为同系物 |
| B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度 |
| C.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 |
| D.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
为探究溴乙烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三名同学分别设计如下三个实验方案:
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
乙:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成, 则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案叙述()
| A.甲正确 | B.乙正确 | C.丙正确 | D.上述实验方案都不正确 |