通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应
Si(s)+4HCl(g),该反应的反应 热△H为 ( )
热△H为 ( )
| A.+412 kJ·mol-1 | B.-412 kJ·mol-1 |
| C.+236 kJ·mol-1 | D.-236 kJ·mol-1 |
H2与O2发生反应的过程用模型图示如下(“—”表示化学键):下列说法不正确的是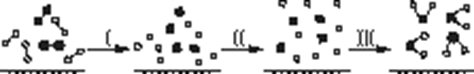
| A.过程Ⅰ是吸热过程 |
| B.过程Ⅲ一定是放热过程 |
| C.该反应过程所有旧化学键都断裂,且形成了新化学键 |
| D.该反应的能量转化形式只能以热能的形式进行 |
将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140 mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是
| A.5 mol/L | B.7 mol/L | C.10 mol/L | D.12 mol/L |
有 MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为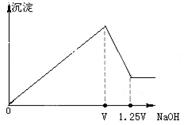
| A.1:1 | B.2:1 | C.3:2 | D.2:3 |
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中不正确的是
| A.此法的优点之一是原料来源丰富 |
| B.①②③步骤的目的是从海水中提取 MgCl2 |
| C.以上提取镁的过程中涉及化合、分解和复分解反应 |
| D.以上提取镁的过程中涉及的反应均不是氧化还原反应 |
关于硅及其化合物的叙述中,不正确的是
| A.硅是良好的半导体材料 |
B.二氧化硅能与石灰石反应:SiO2+CaCO3 CaSiO3+CO2↑ CaSiO3+CO2↑ |
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C  Si +2CO↑ Si +2CO↑ |
| D.水泥的主要成分是 Na2SiO3、CaSiO3和 SiO2 |