氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C 高温 2 AlN + 3CO ,下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为—3 |
| D.氮化铝晶体属于分子晶体 |
下列各组物质中,一定既不是同系物,又不是同分异构体的是
A. 和 和 |
B.乙酸和硬脂酸 |
| C.CH2O2和C3H6O2 | D.苯甲酸和 |
有关下列水解产物叙述不正确的是
| A.油脂水解可得丙三醇 |
| B.可用碘和新制氢氧化铜悬浊液检验淀粉是否完全水解 |
| C.蛋白质水解的最终产物均为氨基酸 |
| D.纤维素水解和淀粉水解得到的最终产物不同 |
稗草烯:α一(2,2, 2-三氯乙基)苯乙烯 ,
,
它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草。温度和湿度对药效影响较大,温度高、湿度大时药效发挥快。在同一剂量下,15℃以下只能起抑制作用, 25 ℃ 以上 3~5 天杂草就枯死。一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害。已知:同一碳原子连两个羟基基不稳定(— —OH
—OH —
—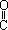 —H)。下列说法不正确的是
—H)。下列说法不正确的是
| A.该物质能使溴水褪色 |
| B.该物质能在碱性条件下可水解生成有机酸盐 |
C.可用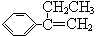 在光照条件下与Cl2通过取代反应制得纯度较高的稗草烯 在光照条件下与Cl2通过取代反应制得纯度较高的稗草烯 |
| D.稗草烯在一定条件下可发生加聚反应 |
下列各组有机物中,两者的一氯代物的种类不等的是
| A.正戊烷和正已烷 | B.对二甲苯和2-甲基丙烷 |
| C.苯与乙烷 | D.甲苯与2,2-二甲基丙烷 |
由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为
| A.15.6% | B.26.7% | C.30% | D.无法确定 |