赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O + Cu2S 6Cu + SO2;对于该反应,下列说法中错误的是
6Cu + SO2;对于该反应,下列说法中错误的是
| A.反应中Cu2S只做氧化剂 |
| B.还原产物与氧化产物的物质的量之比为6:1 |
| C.Cu2O在反应中具有氧化性 |
| D.反应中被氧化的元素是S |
下列试剂不会因为空气中的氧气而变质的是()
| A. | 过氧化钠 | B. | 氢硫酸 | C. | 硫酸亚铁 | D. | 苯酚 |
"玉兔"号月球车用
作为热源材料。下列关于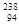 Pu的说法正确的是
Pu的说法正确的是
| A. | 与 互为同位素 | B. | 与 互为同素异形体 |
| C. | 与 具有完全相同的化学性质 | D. | 与 具有相同的最外层电子数 |
已知某温度下 和 的电离常数相等,现向10 浓度为0.1 的 溶液中滴加相同浓度的氨水,在滴加过程中
| A. | 水的电离程度始终增大 |
| B. | 先增大再减小 |
| C. | 与 之和始终保持不变 |
| D. | 当加入氨水的体积为10 时, |
下列有关溶液组成的描述合理的是
| A. | 无色溶液中可能大量存在 、 、 、 |
| B. | 酸性溶液中可能大量存在 、 、 、 |
| C. | 弱碱性溶液中可能大量存在 、 、 、 |
| D. | 中性溶液中可能大量存在 、 、 、 |
苹果酸的结构简式为
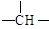 ,下列说法正确的是()
,下列说法正确的是()
| A. | 苹果酸中能发生酯化反应的官能团有2种 |
| B. | 1 苹果酸可与3 发生中和反应 |
| C. | 1 苹果酸与足量金属 反应生成生成1 |
| D. | 与苹果酸互为同分异构体 |