有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种.为了鉴别它们,各取少量溶液进行两两混合,实验结果如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实 验未做.试推断其中F是
验未做.试推断其中F是  ( )
( )
A.Na2CO3溶液 B.BaCl2溶液 C.MgSO4溶液 D.NaHCO3溶液
溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定能大量共存的离子组是
A.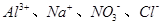 . . |
B.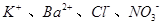 . . |
C.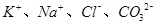 . . |
D.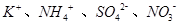 . . |
下列情况下的反应一定能自发进行的是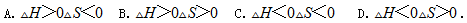
下列各组实验中反应速率最快的是 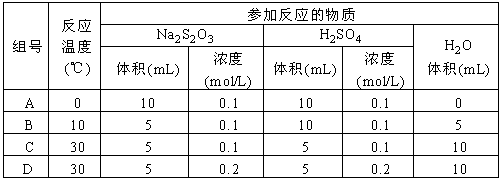
下列有关叙述中正确的是
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质在水溶液中的电离过程是不可逆的 |
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH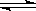 CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |