下列关于化学反应说法中正确的是
| A.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 内生成0.8mol该物质 |
| C.可逆反应达到平衡时,各物质的质量不变, |
| D.化学反应的限度不可以通过改变条件而改变 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )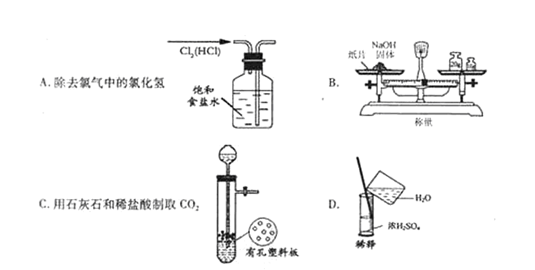
在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的是( )
| A.滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3- |
| B.含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- |
| C.常温下由水电离出来的c(H+)=10-13 mol/L的溶液: K+、HCO3-、Br-、Ba2+ |
| D.含有溶质为NaHSO4的溶液: K+、SiO32-、NO3-、Al3+ |
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是 ( )
| A.Cs显+3价,I 、Cl 均显-1价 |
| B.Cs显 +1价,Cl显+1价,I显-1价、 |
| C.在CsICl2溶液中通入Cl2 ,有单质碘生成 |
| D.在CsICl2溶液中通入SO2气体,有硫酸生成 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A.常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,,则x + y ="46" |
| B.1 mol氯气参加氧化还原反应,一定得到NA或2NA个电子 |
| C.1升0.1 mol·L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是 ( )
①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液 ③硫酸铝溶液与氨水
④硝酸银溶液与氨水⑤溴化亚铁溶液与氯水 ⑥碳酸氢钙溶液与澄清石灰水
| A.③⑤ | B.①③⑥ | C.②④ | D.②③⑥ |