蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的。该矿石的组成以氧化物形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
①固体A的化学式是 ;
②固体F的物质的量是 ;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
| 甲醇 |
64. 7 |
 |
0. 7915 |
易溶于水 |
| 乙醚 |
34. 5 |
 |
0. 7138 |
微溶于水 |
| 3,5-二甲氧基苯酚 |
 |
33 ~36 |
 |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的。
②萃取用到的分液漏斗使用前需并洗净,分液时有机层在分液漏斗的填("上"或"下")层。
(2)分离得到的有机层依次用饱和
溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和
溶液洗涤的目的是;用饱和食盐水洗涤的目的是。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水
干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先,再。
柠檬酸亚铁(
)是一种易吸收的高效铁制剂,可由绿矾(
)通过下列反应制备:
下表列出了相关金属离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1.0
计算)。
| 金属离子 |
开始沉淀的 | 沉淀完全的 |
|
|
1. 1 |
3. 2 |
|
|
3. 0 |
5. 0 |
|
|
5. 8 |
8. 8 |
(1)制备
时,选用的加料方式是(填字母),原因是。
a.将
溶液与
溶液同时加入到反应容器中
b.将
溶液缓慢加入到盛有
溶液的反应容器中
c.将
溶液缓慢加入到盛有
溶液的反应容器中
(2)生成的
沉淀需经充分洗涤,检验洗涤是否完全的方法是。
(3)将制得的
加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是。②反应结束后,无需过滤,除去过量铁粉的方法是(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为
、
、
) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备
晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,,得到
溶液,,得到
晶体。
某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许固体物质于试管中,并向试管中加稀硫酸得溶液B;
②取少量溶液B于试管中,滴加几滴KSCN溶液,结果溶液未变红色,说明硬质试管中固体物质的成分有:____________________________。(填化学式)
(3)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图
所示的操作,可观察到先生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:
①;
②。
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是。(用离子方程式表示)
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________(用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将的上述溶液沿玻璃棒注入___________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度线1-2cm时,改用加水,使溶液凹液面跟刻度相平。
(6)用“偏高”“偏低”或“无影响”填空:
① 定容时,观察液面俯视:;
② 摇匀后,液面低于刻度线,没有再加水:;
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:。
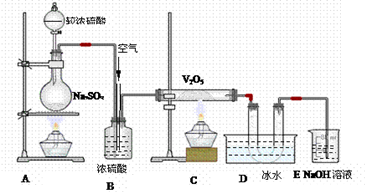
分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为,
(2)装置C的直玻管中发生的反应的化学方程式为,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是,
(4)装置E中NaOH的作用是,反应的离子方程式为;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________; __________________________________。