下列除杂的实验方法不正确的是
| A.除去CO2中的HCl气体:通过饱和NaHCO3溶液后再干燥气 |
| B.除去Na2CO3固体中的NaHCO3:置于坩埚中加热 |
| C.除去Cl2中的HCl气体:通过NaOH溶液后再干燥气体 |
| D.除去FeCl3酸性溶液中的FeCl2:通入足量的Cl2 |
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是()
| A.开始时产生的气体为H2 |
| B.AB段产生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol·L-1 |
| D.参加反应铁粉的总质量m2=5.6 g |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是()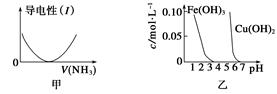
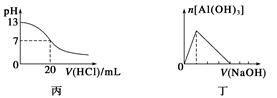
| A.图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
下列图示与对应的叙述相符的是()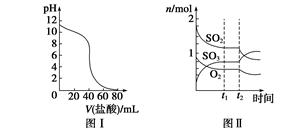
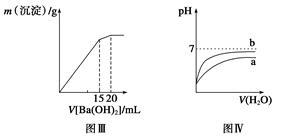
| A.图Ⅰ表示常温下盐酸滴加到0.1 mol·L-1某碱溶液中得到的滴定曲线,由图Ⅰ可知二者恰好中和时,所得溶液的pH>7 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
下列图示与对应的叙述相符的是()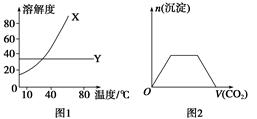
| A.图1表明可用蒸馏法分离X、Y |
| B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2 |
| C.图3表示向盐酸和醋酸混合溶液中滴入氨水 |
| D.图4表示曲线b过程的热化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ· |
mol-1
下列图示与对应叙述相符的是()
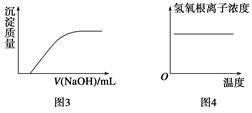
| A.图1反应达到平衡后,升高温度,平衡常数K值变大 |
| B.图2表示镁条放入盐酸中生成氢气速率随时间的变化 |
| C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化 |
| D.图4表示纯碱溶液受热时氢氧根浓度随温度的变化 |