(1)大气中SO2含量过高会导致雨水中含有 (填化学式)而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。
(2)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
 (3)合成氨的反应N2(g)+3H2(g)
(3)合成氨的反应N2(g)+3H2(g)  2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a.升高温度 b.加入催化剂 c.增加H2的浓度
d.增加N2的浓度 e.分离出NH3  (4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
可逆反应2SO2 + O2  2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题: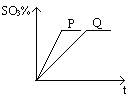
(1)如果两条曲线为其它条件相同,分别为使用和不使用催化剂,则曲线表示使用了催化剂,并且从图象可知,催化剂可以但不能
(2)请你再提出能增大该反应反应速率的两条措施和。
已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用化学用语表达),溶液中所含有的离子浓度由大到小的顺序为____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出化学式:A___________________ D_________________________。
(2)写出A与E反应的离子方程式_____________________________________________。
(3)25℃时将40mL0.01mol·L-1B与20mL0.01mol·L-1C混合,最终溶液pH=____________。
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:。
接触法制硫酸的核心反应是2SO2(g) + O2(g) 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
(1) 0min~4min内生成O2平均速率v(O2)=;如果0min~4min内SO3生成速率平均为x,4min~8min内SO3生成速率平均为y,8min~10min内SO3生成速率平均为z(其它条件不变,且忽略反应中温度变化),则x、y、z大小关系为______________。
(2) 达到平衡时c(O2)=c(SO2),则a=mol·L-1;如果此时在平衡体系中加入0.5molN2,则SO2在混合气中所占的体积分数____________(填“增大”、“减小”或“不变”)
(3) 若起始时n(SO3)、n(SO2)、n(O2)(/mol)分别按下列4组数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是。
| A.1、2、2 | B.3、1.5、1 | C.3、0、0 | D.0、6、5 |
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)图中表示NO2的变化的曲线是____________。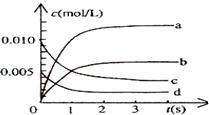
(2)能说明该反应已经达到平衡状态的是___________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂