向100 mL 0.l mol·L—1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.l mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。下列说法中正确的 ( )
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是:Al3++2SO2-4+2Ba2++3OH—→Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |
在T℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
| A.溶质的质量分数为w=×100% |
| B.溶质的物质的量浓度c= mol/L |
| C.溶液中c(OH-)= mol/L |
| D.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w |
有机物A的分子式为C6H12O2。在一定条件下发生如下图所示转化。已知D和E都不能发生银镜反应,由此推断A的可能结构有()
| A.2种 | B.3种 |
| C.4种 | D.6种 |
下列有关实验操作的叙述正确的是( )
| A.用量筒量取5.00 mL 1.00 mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100 mol/L盐酸 |
| B.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| C.用10 mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D.质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15% |
某种利胆解痉药的有效成分是亮菌甲素,结构简式如图。关于亮菌甲素的说法正确的是( )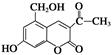
| A.亮菌甲素的分子式为C12H12O5 |
| B.1mol亮菌甲素最多能和4 molH2发生加成反应 |
| C.1mol亮菌甲素最多能和2 molNaOH反应 |
| D.亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
已知 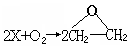 是原子利用率为100%的转化。对X的推断中不正确的是()
是原子利用率为100%的转化。对X的推断中不正确的是()
| A.可使酸性高锰酸钾溶液褪色 | B.能与HCl发生加成反应 |
| C.能发生银镜反应 | D.与丙烯互为同系物 |