有一混合溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现各取100 mL溶液三份进行如下实验:①向第一份中加入AgNO3溶液,有白色沉淀产生;②向第二份中加入足量NaOH溶液后加热,收集到的气体体积为0.896L(标准状况下);③向第三份中加入足量BaCl2溶液,得到沉淀总质量为6.27 g,沉淀经 足量盐酸洗涤后,剩余2.33 g。请回答下列问题:
(1)该溶液中肯定存在的离子有 ,肯定不存在的离子有 。
(2)溶液中可能存在的离子是 ,为确定该离子是否存在,可采取的实验操作是
(3)其中肯定存在的离子在原溶液中的物质的量浓度分别为 。
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在温度为70~80℃的水浴中,目的是________________________。
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
(3)乙醇的催化氧化反应是反应(填“放热”或“吸热”),该反应的化学方程式为。
(4)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是,
②若鼓气速度过快反应会停止,原因:,
③若鼓气速度过慢反应也会停止,原因:。
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_____________、______________接丙。
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应 来制取并收集氯气,实验装置如图所示。
来制取并收集氯气,实验装置如图所示。

 ⑴写出该反应的化学方程式:
⑴写出该反应的化学方程式: ⑵上述反应中,盐酸表现出性质是。
⑵上述反应中,盐酸表现出性质是。 (3)实验开始时,某学生对实验装置进行了气密性检查,
(3)实验开始时,某学生对实验装置进行了气密性检查, 方法是
方法是
 (4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是。
(4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是。 A.NaOH 溶液 B.Na2CO3溶液 C.浓硫酸
A.NaOH 溶液 B.Na2CO3溶液 C.浓硫酸 (5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积(填大于、小于或等于)2.24L,原因是
(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积(填大于、小于或等于)2.24L,原因是
工业上测定SO2、N2、O2混合气体中SO2含量的装置如图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI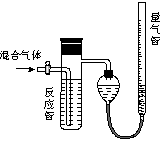
(1)混合气体进入反应管后,量气管内增加的水的体积等于_____________的体积(填写混合气体的分子式)
(2)读数前应冷却到室温、______________、___________
(3)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_______(选填:偏高,偏低,不受影响)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为______________________。
某同学用如图所示的装置进行铜与浓硫酸反应的实验。
请回答:
(1)铜与浓硫酸反应的化学方程式是________________________
(2)实验过程中,观察到品红溶液________________,石蕊溶液________________,说明SO2________(填选项)。
a. 有氧化性 b. 有还原性 c. 有漂白性 d. 水溶液显酸性
(3)为进一步确认产生的气体是二氧化硫气体,还应补充的操作是________________
(4)结合离子方程式说明试管D中氢氧化钠溶液的作用是______________________
(5)把试管A中的液体冷却后慢慢倒入盛有水的烧杯里,观察到溶液呈________色,说明铜元素被氧化生成了________离子。
某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸 b. 碱石灰 c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________