在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
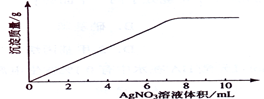

| A.+1 | B.+2 | C.+3 | D.+4 |
下列叙述中正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 |
| C.马口铁(镀锡铁)破损后若与电解质溶液接触,锡先被腐蚀 |
| D.铜锌原电池工作时,若有13 g锌被溶解,则电路中有0.4 mol 电子通过 |
下列事实不能用电化学原理解释的是( )
| A.铝片不用特殊方法保护 |
| B.轮船水线下的船体上装一定数量的锌块 |
| C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 |
| D.镀锌铁比镀锡铁耐用 |
把锌片投入到下列溶液中,锌片溶解且溶液质量减轻,又没有气体产生的是( )
| A.H2SO4 | B.CuSO4 |
| C.ZnSO4 | D.AgNO3 |
利用维生素C能使淀粉碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。要得出正确结论,在实验时需要控制的条件是( )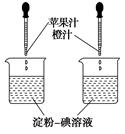
| A.实验时必须向两烧杯中同时滴加液体 |
| B.淀粉碘溶液的体积和浓度必须相等 |
| C.胶头滴管滴出的果汁的滴数必须相等 |
| D.胶头滴管滴出的每滴果汁的体积不用相等 |
已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol·L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2。下列说法正确的是(双选)( )
A.设锌镀层单侧厚度为h,锌的密度为ρ,则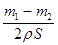 =h =h |
| B.锌电极上发生还原反应 |
| C.锌和石墨形成原电池,外电路中电流从锌流向石墨 |
| D.当石墨不再产生气泡时,应立即取出铁皮 |