下列关于反应能量的说法正确的是( )
| A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E反应物<E生成物 |
| B.CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.5 kJ·mol-1,E反应物<E生成物 |
| C.HI(g)H2(g)+I2(s) ΔH=-26.5 kJ·mol-1,1 mol HI在密闭容器中分解达平衡后放出26.5 kJ的能量 |
| D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,1 L 1 mol·L-1的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放热57.3 kJ |
下列各组离子中,因相互促进水解,而不能大量共存的是()
A.OH-、Na+、K+、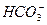 |
B.Na+、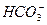 、Al3+、Cl- 、Al3+、Cl- |
C.H+、HS-、Na+、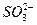 |
D.Al3+、 、H+、Cl- 、H+、Cl- |
有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的pH依次为9、10、8,则这三种弱酸的酸性由强到弱的顺序是()
A.HA>HB>HCB.HB>HA>HCC.HC>HB>HAD.HC>HA>HB
下列各反应离子方程式中,属于水解反应的是()
A.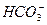 +H2O +H2O H3O++ H3O++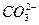 |
B.HS-+H2O H2S+OH- H2S+OH- |
C.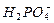 +H2O +H2O 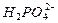 +H3O+ +H3O+ |
D.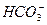 +OH- +OH- H2O+ H2O+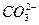 |
物质的量相同的下列溶液中,含粒子种类最多的是()
| A.CaCl2 | B.CH3COONa | C.NH3 | D.K2S |
有4种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,据测试,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH大于7,BX溶液的pH小于7。据此推知其中可能不水解的盐是()
| A.AX | B.BX | C.AY | D.BY |