铁氧磁体法处理 的废水的原理可概述为:向
的废水的原理可概述为:向 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol 的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
| A.x= 0.5 , a= 8 | B.x = 0.5 , a=10 | C.x = 1.5 , a= 8 | D.x = 1.5 , a= 10 |
已知在密闭容器里反应:mX(g)+nY(g) qZ(g)ΔH;反应物Y与反应时间t、温度T、压强p的关系曲线见右图,试通过对此曲线的分析,判断下列描述中正确的是
qZ(g)ΔH;反应物Y与反应时间t、温度T、压强p的关系曲线见右图,试通过对此曲线的分析,判断下列描述中正确的是
| A.T1<T2、p2<p1、m+n>q、ΔH<0 |
| B.T1<T2、p2<p1、m+n>q、ΔH>0 |
| C.T1>T2、p1<p2、m+n<q、ΔH>0 |
| D.T1>T2、p1<p2、m+n<q、ΔH<0 |
密闭容器中,反应xA(g)+yB(g)=zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L.下列判断正确的是()
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数增大 |
向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如 下反应:2A(g)+B(g)
下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是()
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是()
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
| A.①②③ | B.①③⑤ | C.②④⑤ | D.①③④ |
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。
据此,下列叙述正确的是
A铅笔端作阳极,发生氧化反应
B、铂片端作阴极,发生还原反应
C铅笔端有少量的氯气产生
D a点是负极,b点是正极
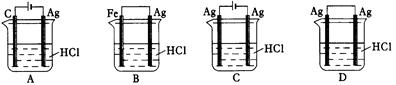
某同学为了使反应2HCl + 2Ag 2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是()
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是()