水是生命之源,它 与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子与H+形成水合氢离子( H3O +)的立体构型为 。
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中与冰的晶体类型相同的是 ;(填写编号)。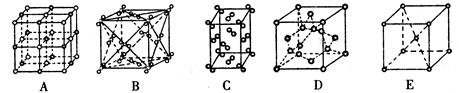
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),
已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmd 氢键所需的能量即为氢键的“键能”)是 KJ kJ / mol 。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH不可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)
下图中每一方框代表一种反应物或生成物: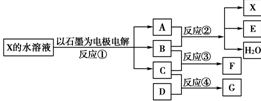
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
| C |
D |
G |
|
| 起始 |
3 mol |
1 mol |
0 |
| 3 min时 |
2.4 mol |
0.8 mol |
0.4 mol |
①写出反应②的离子方程式___________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: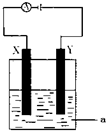
①若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为,电解时的化学反应方程式为,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,,则Y极的电极反应式为
③若用此装置电解精炼铜,做阳极,电解液CuSO4的浓度(填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做,电镀液的浓度(填“增大”、“减小”或“不变”)。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_____.
(2)④、⑤、⑦、⑧四种溶液中NH浓度由大到小的顺序是(填序号)________.
(3)将①和⑧等体积混合后,混合液中各离子浓度关系正确的是________.
| A.c(H+)>c(SO)>c(NH)>c(OH-) |
| B.c(H+)=c(SO)=c(NH)>c(OH-) |
| C.c(NH)>c(H+)=c(SO)>c(OH-) |
| D.c(OH-)>c(H+)>c(NH)=c(SO) |
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为,火法炼铜的反应原理是(用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式:。
⑶若将A中单质反应,操作加入试剂最好是。
A.加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是。
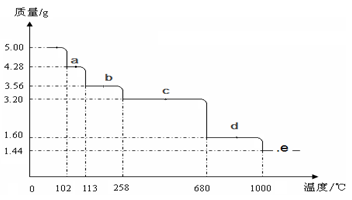
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式,e点的化学式(计算过程略去)。