长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈地动摇了。他们在0℃以下将氟从细冰上面通过,得到了毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液。则下列说法中不正确的( )
| A.次氟酸分子中原子间以共价键相结合 | B.次氟酸分解会产生氟气 |
| C.次氟酸与热水反应可能有H2O2生成 | D.次氟酸的酸性可能比次氯酸强 |
某种溶液只含下表离子中的几种(不考虑水的电离与离子水解),且各种离子的物质的量浓度均为0.1 mol·L-1。
| 阳离子 |
K+ NH4+Fe2+Mg2+ Al3+Cu2+ |
| 阴离子 |
OH- Cl- AlO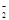 CO CO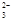 SO SO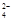 SiO SiO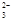 |
某同学进行了如下实验(必要时可加热):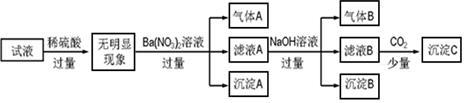
下列说法正确的是
A.原溶液中只含有NH4+、Fe2+、Cl-、SO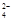
B.由沉淀A推断原溶液中一定含有SO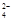
C.滤液A中可能含有K+、Al3+、Cl-
D.沉淀B中一定含有Mg(OH)2
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
醋酸 |
次氯酸 |
碳酸 |
亚硫酸 |
| 电离平衡常数(25℃) |
Ka=1.75×10-5 |
Ka=2.98×10-8 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO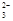 +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO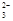 =SO
=SO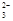 +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O  Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
| A.闭合K时,X的电极反应式为:2H++2e-= H2↑ |
| B.闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2 |
| C.给装置(Ⅰ)充电时,B极参与反应的物质被氧化 |
| D.给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极 |
为完成相应实验,实验器材(规格和数量不限)足够的一项是
| 相应实验 |
实验器材(省略夹持装置) |
|
| A |
氯化钠溶液的浓缩结晶 |
烧杯、玻璃棒、酒精灯 |
| B |
用盐酸除去硫酸钡中的少量碳酸钡 |
烧杯、漏斗、胶头滴管、滤纸 |
| C |
用浓硫酸配制0.5mol·L-1的溶液 |
烧杯、玻璃棒、胶头滴管、容量瓶 |
| D |
用溴水和CCl4除去NaBr溶液中的少量NaI |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用pH传感器测得0.10mol·L-1Na2CO3溶液从55℃升高至85℃的pH如图所示。在55℃升高至85℃升温过程中,下列说法正确的是
| A.c(H+)增大,c(OH-)减小 |
| B.c(CO32-)/c(HCO3-)比值不断增大 |
C.c(CO )+c(HCO3-) +c(H2CO3)=0.10 )+c(HCO3-) +c(H2CO3)=0.10 |
| D.c(OH-) - c(HCO3-) - c(H2CO3)=10-11.1 |