高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1 mol Na2FeO4共转移4 mol电子 |
| C.湿法中每生成1 mol Na2FeO4共转移3 mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
下列说法中正确的是( )
| A.铁的摩尔质量就是铁的相对原子质量 | B.CO32-的摩尔质量是60g/mol |
| C.1molO2的质量是32g/mol | D.CO2的摩尔质量是44g |
下列粒子中,核外电子总数相同的是 ()
①F- ②Na+ ③Ne ④K+ ⑤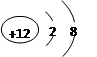
| A.①②③⑤ | B.①②④⑤ | C.①②③④ | D.②③④⑤ |
选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是()
| A.不溶于水,且必须比水密度大 | B.不溶于水,且必须比水密度小 |
| C.不溶于水,且必须易与碘发生化学反应 | D.不溶于水,且比水更易溶解碘 |
实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①停止加热、余热蒸干;② 固定铁圈位置;③ 放上蒸发皿;④ 加热搅拌;⑤放置酒精灯。其正确的操作顺序为 ( )
①停止加热、余热蒸干;② 固定铁圈位置;③ 放上蒸发皿;④ 加热搅拌;⑤放置酒精灯。其正确的操作顺序为 ( )
| A.⑤②③④① | B.①②③④⑤ | C.⑤②③①④ | D.⑤②①③④ |
关于过滤操作的描述,不正确的是 ( )
| A.滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡 |
| B.漏斗内的过滤液的液面应高于滤纸边缘 |
| C.要沿着玻璃棒慢慢向漏斗中倾倒过滤液 |
| D.漏斗下端管口应紧靠烧杯内壁 |