无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )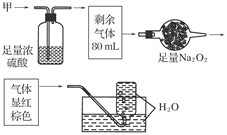
| A.NH3、NO2、N2 | B.NH3、NO、CO2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
下列事实不能用勒沙特列原理解释的是:
| A.新制的氯水在光照条件下颜色变浅 |
| B.加入催化剂可以加快合成氨的速率 |
| C.实验室中常用排饱和食盐水的方法收集氯气 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
| A.0.5mol·L—1 | B.1.5 mol·L—1 | C.0.4 mol·L—1 | D.0.25 mol·L—1 |
下列实验操作中正确的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏时,温度计水银球靠近蒸馏烧瓶的底部 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.检验溶液中是否含有NH4+:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素既被氧化又被还原 |
| B.氧化剂与还原剂的物质的量之比为1:2 |
| C.每生成1molNa2S2O3,转移4mol电子 |
| D.相同条件下,每吸收10m3SO2就会放2.5m3CO2 |
下列关于物质的量浓度表述正确的是
| A.0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol |
| B.50mL2mol·L-1NaCl溶液和100mL0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等 |
| C.用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol·L-1 |
| D.10g98%的硫酸(密度为1.84g·cm—3)与10mL18.4mol·L—1的硫酸的浓度是相同的 |