在一定温度下,在aL的密闭容器中发生反应:4A(s)+3B(g) 2C(g)+D(g),经2 min后B的浓度减少0.6 mol/L。对此反应的说法正确的是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol/L。对此反应的说法正确的是( )
A.分别用B、C、D表示反应的速率,其比值是3 ∶2 ∶1
B.用A表示的反应速率是0.4 mol/(L·min)
C.容器内压强不随时间变化时标志着此反应达到平衡状态
D.在这2 min内用B和C表示的反应速率的值一定都是逐渐减小的
下列溶液中有关物质的量浓度关系和计算不正确的是
| A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa) |
B.已知25°C时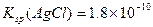 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到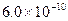 mol·L-1 mol·L-1 |
| C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 |
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有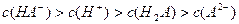 |
下列离子方程式正确的
A.往碳酸氢钙溶液中滴入少量氢氧化钠溶液:OH-+HCO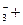 Ca2+ Ca2+ =CaCO3↓+H2O =CaCO3↓+H2O |
| B.将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+====Cu+2Na+ |
C.NaHCO3溶液显碱性:HCO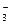 +H2O +H2O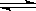 OH- +CO OH- +CO |
D.氯气溶解于水:Cl2+H2O 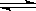 2H++Cl-+ClO- 2H++Cl-+ClO- |
某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能 实现该反应的原电池是
实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质为F eCl3溶液 eCl3溶液 |
| B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液 |
| C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 |
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)
| 阳离子 |
Mg2+、Ag+、Na+ |
| 阴离子 |
 、 、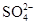 、 、 |
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除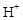 、
、 外还含有五离子。则A的化学式不可能是
外还含有五离子。则A的化学式不可能是
A、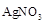 B、
B、 C、
C、 D、
D、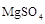
下列各组给定原子序数的元素,不能 形成原子数之比为1:1的稳定化合物是
形成原子数之比为1:1的稳定化合物是
| A.3和17 | B.1和8 | C.1和6 | D.7和12 |